Noviembre nos trae a presentar El peso atómico.
Bienvenidos a todos a noviembre, y también a una nueva entrada del blog, si no has leído las de septiembre, puede que no sepas que estamos dedicando estas últimas publicaciones a entender términos químicos, asociados a química básica y la tabla periódica, así pues, te invito a que conozcas en esta publicación al peso atómico.
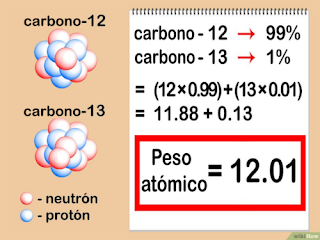
Presentamos ahora el peso atómico
El peso
atómico es una cantidad física adimensional, definida como la razón del promedio de las masas de los
átomos de un elemento (de una muestra dada o fuente) con respecto a la doceava
parte de la masa de un átomo de carbono-12 (conocida como
una unidad de masa atómica unificada).
El
concepto se utiliza generalmente sin mayor calificación para referirse
al peso atómico estándar, que a intervalos regulares publica la Comisión sobre
Abundancia de Isótopos y Pesos Atómicos de la IUPAC. Se pretende que sean aplicables a materiales de laboratorios
normales.
Se
denomina isótopos a los átomos de un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones, y por lo tanto, difieren en número
másico.
La palabra
isótopo se usa para indicar que todos los tipos de átomos de un mismo elemento químico (isótopos) se encuentran en el mismo sitio de la tabla periódica. Los átomos que son isótopos entre sí son los que tienen
igual número atómico (número de protones en el núcleo), pero diferente número másico (suma del número de neutrones y el de protones en el núcleo). Los distintos isótopos de un
elemento difieren, pues, en el número de neutrones.
La mayoría
de los elementos químicos tienen más de un isótopo. Solamente 8 elementos (por
ejemplo berilio o sodio) poseen un solo isótopo natural. En contraste, el estaño es el elemento con más isótopos estables, 10.
Otros
elementos tienen isótopos naturales, pero inestables, como el uranio, cuyos isótopos pueden transformarse
o decaer en otros isótopos más estables, emitiendo en el proceso radiación, por lo que se dice que son radiactivos.
Los isótopos inestables son útiles para estimar la edad de una gran variedad de muestras naturales, como rocas y materia orgánica. Esto es posible, siempre y cuando, se conozca el ritmo promedio de desintegración de determinado isótopo, en relación a los que ya han decaído. Gracias a este método de datación, se puede estimar la edad de la Tierra.
Tipos de isótopos
Todos los
isótopos de un mismo elemento tienen el mismo número atómico pero difieren en lo que actualmente se conoce como número másico.
Si la
relación entre el número de protones y de neutrones no es la apropiada para
obtener la estabilidad nuclear, el isótopo es radiactivo.
Por
ejemplo, en la naturaleza el carbono se presenta como una mezcla de tres isótopos con números
másicos 12, 13 y 14: 12C, 13C y 14C. Sus abundancias respecto a la cantidad global de carbono son
respectivamente 98,89 %, 1,11 % y trazas.
- Isótopos
naturales. Los isótopos naturales son aquellos que se encuentran en la
naturaleza. Por ejemplo, el hidrógeno tiene tres isótopos naturales, el protio,
el deuterio y el tritio. El tritio es muy usado en trabajos de tipo nuclear; es
el elemento esencial de la bomba de hidrógeno.
Otro elemento que está formado por isótopos muy importantes es el carbono, que son el carbono-12, que es la base referencial del peso atómico de cualquier elemento, el carbono-13 que es el único carbono con propiedades magnéticas y el carbono-14 radiactivo, muy importante ya que su semivida es de 5730 años y se usa mucho en arqueología para determinar la edad de los fósiles orgánicos. El uranio-235 se usa en las centrales nucleares y en las bombas atómicas.
Isótopos artificiales. Los isótopos artificiales se producen en laboratorios nucleares por bombardeo de partículas subatómicas o en las centrales nucleares. Estos isótopos suelen tener una vida corta, principalmente por la inestabilidad y radioactividad que presentan. Uno de estos es el cesio, cuyos isótopos artificiales se usan en plantas nucleares de generación eléctrica. Otro muy usado es el iridio-192 que se usa para comprobar la hermeticidad de las soldaduras de tubos, sobre todo en tubos de transporte de crudo pesado y combustibles. Algunos isótopos del uranio como el uranio-233 también se usan en tecnología nuclear.
Los
isótopos se subdividen en isótopos estables (existen menos de 300) y no
estables o isótopos radiactivos (existen alrededor de 1200). El concepto de
estabilidad no es exacto, ya que existen isótopos casi estables. Su estabilidad
se debe al hecho de que, aunque son radiactivos, tienen un periodo de semidesintegración extremadamente largo comparado con la edad de la Tierra.
|
Isótopos
más abundantes |
|
|
Isótopo |
Núcleos por |
|
Hidrógeno-1 |
705 700 |
|
Hidrógeno -2 |
23 |
|
Helio-4 |
275 200 |
|
Helio-3 |
35 |
|
Oxígeno-16 |
5920 |
|
Carbono-12 |
3032 |
|
Carbono-13 |
37 |
|
Neón-20 |
1548 |
|
Neón-22 |
208 |
|
Hierro-56 |
1169 |
|
Hierro-54 |
72 |
|
Hierro-57 |
28 |
|
Nitrógeno-14 |
1105 |
|
Silicio-28 |
653 |
|
Silicio-29 |
34 |
|
Silicio-30 |
23 |
|
Magnesio-24 |
513 |
|
Magnesio-26 |
79 |
|
Magnesio-25 |
69 |
|
Azufre-32 |
39 |
|
Argón-36 |
77 |
|
Calcio-40 |
60 |
|
Aluminio-27 |
58 |
|
Níquel-58 |
49 |
|
Sodio-23 |
33 |
Notación
Inicialmente
los nombres de los isótopos de cada elemento que se iban descubriendo recibieron nombres propios
diferentes al del elemento al que pertenecían. Así cuando se descubrieron tres
isótopos del hidrógeno, recibieron los nombres de protio, deuterio y tritio. El núcleo del protio consta de un protón, el del deuterio de un protón y un neutrón, y el del tritio de un protón y dos neutrones.
Cuando se
siguieron descubriendo isótopos de casi todos los elementos se vio que serían
necesarios cientos o miles de nombres y se cambió el sistema de nomenclatura.
Actualmente cada isótopo se representa con el símbolo del elemento al que pertenece, colocando como subíndice a la izquierda su número
atómico (número de protones en el núcleo),
y como superíndice a la izquierda su número
másico (suma del número de protones y de
neutrones). Así los isótopos del hidrógeno protio, deuterio y tritio se
denotan 11H, 12H y 13H,
respectivamente.
Como todos
los isótopos de un mismo elemento tienen el mismo número atómico, que es el
orden en la tabla periódica, y el mismo símbolo, habitualmente se omite el número atómico. Así
para los isótopos del hidrógeno escribiremos 1H, 2H
y 3H. Esto se hace porque todos los isótopos de un elemento
particular se comportan de la misma manera en cualquier reacción química. Por ejemplo, un átomo del escaso isótopo de oxígeno que tiene
número másico 18, se combinará
exactamente igual con dos átomos de hidrógeno para formar agua que si se tratara del abundante átomo de oxígeno de número másico 16. Sin embargo, cuando se están
describiendo reacciones
nucleares es útil tener el número atómico
como referencia.
En el caso
de textos no científicos, como textos periodísticos, esta notación con
subíndices y superíndices es incómoda, por lo que también se usa una notación
consistente en el nombre del elemento unido por un guion al número másico del
isótopo de que se trate. De esta forma los isótopos del hidrógeno 11H, 12H
y 13H, también se pueden nombrar como hidrógeno-1,
hidrógeno-2 e hidrógeno-3 respectivamente.
Estas son
las reglas de nomenclatura científicamente aceptadas, correspondientes a
la Nomenclatura de Química Inorgánica. Recomendaciones de 2005 (Libro
Rojo de la IUPAC), tal y como se pueden encontrar en su sección IR-3.3.
Hay que
recordar que los nombres de los elementos químicos son nombres comunes y como
tales deben escribirse sin mayúscula inicial, salvo que otra regla ortográfica
lo imponga.
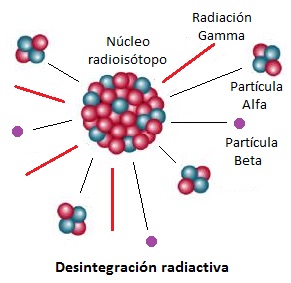
Radioisótopos
Los
radioisótopos son isótopos radiactivos ya que tienen un núcleo atómico inestable y emiten energía y partículas cuando se transforman
en un isótopo diferente más estable. La desintegración puede detectarse con
un contador Geiger o con una película
fotográfica.
La
principal razón de la inestabilidad está en el exceso de protones o neutrones.
La fuerza nuclear fuerte, que une protones y neutrones entre sí, requiere que la cantidad
de neutrones y protones esté cerca de cierta relación. Cuando el número de
neutrones es superior al que requiere esta relación el átomo puede
presentar decaimiento
beta negativo. Cuando el átomo tiene un exceso de
protones (defecto de neutrones) suele presentar decaimiento
beta positivo.
Esto
sucede porque la fuerza nuclear fuerte residual depende de la proporción de
neutrones y protones. Si la relación está muy sesgada hacia uno de los extremos
la fuerza nuclear débil responsable del decaimiento beta puede producir
esporádicamente la pérdida de algún nucleón. Para números atómicos elevados (Z > 80) también se vuelve frecuente
la desintegración
alfa (que casi es mucho más frecuente
cuando además hay exceso de protones).
Cada
radioisótopo tiene un periodo de semidesintegración o semivida característico. La energía puede ser liberada principalmente
en forma de radiación alfa (partículas constituidas por núcleos de helio), beta (partículas formadas por electrones o positrones) o gamma (energía en
forma de radiación electromagnética).
Varios
isótopos radiactivos inestables y artificiales tienen usos en técnicas de radioterapia en medicina. Por ejemplo, un isótopo del tecnecio (99mTc, la "m" indica que es
un isómero nuclear metaestable) puede usarse para identificar vasos sanguíneos bloqueados.
Varios
isótopos radiactivos naturales se usan en datación
radiométrica para determinar cronologías, por ejemplo, arqueológicas.
Aplicaciones de los isótopos
Las
siguientes son varias de las aplicaciones de diferentes isótopos en diversas
áreas, como la medicina:
·
Cobalto-60.
Para el tratamiento del cáncer porque
emite una radiación con
más energía que
la que emite el radio y es más barato que este.
·
Arsénico-73.
Se usa como trazador para estimar la cantidad de arsénico absorbido por el
organismo y el arsénico-74 en la localización de tumores cerebrales.
·
Bromo-82. Útil para hacer estudios de hidrología tales
como determinación de caudales de agua, direcciones de flujo de agua y tiempos
de residencia en aguas superficiales y subterráneas, determinación de la
dinámica de lagos y fugas en embalses.
·
Oro-19. De gran aplicación en la industria
del petróleo:
perforación de pozos para búsqueda de petróleo, estudios de recuperación
secundaria de petróleo, que se adelantan en la determinación de producción
incremental e industria petroquímica en general.
·
Fósforo-32.
Es un isótopo que emite rayos beta y
se usa para diagnosticar y tratar enfermedades relacionadas con los huesos y con la médula ósea.
·
Escandio-46.
Aplicable en estudios de sedimentología y
análisis de suelos.
·
Lantano-140.
Usado en el estudio del comportamiento de calderas y hornos utilizados en el sector industrial.
·
Mercurio-197.
De aplicación en celdas
electrolíticas.
·
Nitrógeno-15.
Se emplea a menudo en investigación
médica y en agricultura.
También se emplea habitualmente en espectroscopia de resonancia magnética nuclear (NMR).
·
Yodo-131. Es uno de los radionucleidos
involucrados en las pruebas nucleares atmosféricas,
que comenzaron en 1945. Aumenta el riesgo de cáncer y posiblemente otras enfermedades
del tiroides y
aquellas causadas por deficiencias hormonales tiroideas.
·
Radio-226.
En tratamientos para curar el cáncer de
la piel.
·
Tritio, 3H.
El tritio tiene aplicaciones médicas como rastreador ya que al descomponerse,
como hemos visto, emite electrones de baja energía pero no rayos γ (que es un
tipo de radiación mucho más peligrosa). La bomba de hidrógeno es en realidad
bomba de tritio.
·
Tecnecio-99.
Puede usarse para identificar vasos sanguíneos bloqueados.
·
Oxígeno-18
y Deuterio.
Estos dos isótopos se usa muy comúnmente para inferir la temperatura de
la tierra en el pasado.
Utilización de las propiedades químicas
En
el marcado isotópico, se usan isótopos inusuales como marcadores de reacciones
químicas. Los isótopos añadidos reaccionan químicamente igual que los que están
presentes en la reacción, pero después se pueden identificar por espectrometría
de masas o espectroscopia infrarroja. Si se usan radioisótopos, se pueden detectar también gracias a las radiaciones que emiten.
Los procesos de separación
isotópica o enriquecimiento
isotópico representan un desafío.
Conclusión
Artículo escrito por Ana María Morón Usero o Ammu.
Tras todo esto, gracias por leer, que la ciencia y la fuerza os acompañe




.jpg)

Comentarios