Conceptos importantes para entender a un/@ químic@
Conceptos de la química
Enlace de la imagen: https://concepto.de/formula-quimica/
El mol se usa como contador de unidades, como la docena (12) o el millar (1000),y equivale a . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar de un elemento está basada en la masa de un mol de dicho elemento). Se dice entonces que el mol es una unidad de cambio. El mol tiene relación directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro, conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente, equivale al número de partículas presentes en 1 mol de dicha sustancia:1 mol de glucosa equivale a moléculas de glucosa. 1 mol de uranio equivale a átomos de uranio.
- Fórmula molecular. Es un tipo de fórmula bastante básica que expresa el tipo de átomos presentes en un compuesto covalente y la cantidad de cada uno. Utiliza una secuencia lineal de símbolos de los elementos químicos y números (como subíndices). Por ejemplo, la fórmula molecular de la glucosa es C6H12O6 (seis átomos de carbono, doce de hidrógeno y seis de oxígeno).
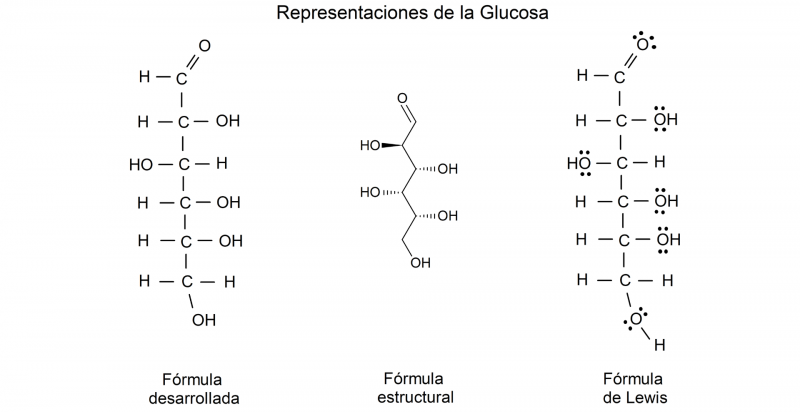
- Fórmula semidesarrollada. Similar a la fórmula molecular, es un tipo de fórmula que expresa los átomos que integran el compuesto y expresa también los enlaces químicos (líneas) y su tipo (simples, dobles, triples) entre cada átomo del compuesto. En esta fórmula no se representan los enlaces carbono-hidrógeno. Esto es útil para identificar los grupos radicales que lo conforman, así como su estructura química. Por ejemplo, la fórmula semidesarrollada de la glucosa es, CH2OH – CHOH – CHOH – CHOH – CHOH – CHO .
- Fórmula desarrollada. La fórmula desarrollada es el paso siguiente en complejidad de la semidesarrollada. En esta representación se indica el enlace y la ubicación de cada átomo del compuesto dentro de sus respectivas moléculas, en un plano cartesiano, representando la totalidad de la estructura del compuesto.
- Fórmula estructural. Para representar las moléculas ya no solo en su estructura y organización sino además en su forma espacial, hace falta una fórmula todavía más compleja, que emplea perspectivas bi o tridimensionales.
- Fórmula de Lewis. También llamadas “diagramas de Lewis” o “estructuras de Lewis”, se trata de una representación similar a la fórmula desarrollada de un compuesto, pero que indica los respectivos electrones compartidos en cada enlace químico entre átomos, de acuerdo a la valencia de los elementos involucrados. Estos electrones se representan mediante puntos enlazados con una línea donde hay un enlace. También se representan los electrones no compartidos usando puntos sobre el átomo correspondiente. Son fórmulas muy específicas y de uso técnico.
Dentro de los átomos
puede existir un núcleo atómico y uno o más electrones. Los electrones son muy importantes para las
propiedades y las reacciones químicas. Dentro del núcleo se encuentran los
neutrones y los protones. Los electrones se encuentran alrededor del núcleo.
También se dice que el átomo es la unidad básica de la materia con
características propias. Está formado por un núcleo, donde se encuentran los
protones.
De átomos a
moléculas: Los enlaces son
las uniones entre átomos para formar moléculas. Siempre que existe una molécula
es porque ésta es más estable que los átomos que la forman por separado. A
la diferencia de energía entre estos dos estados se le denomina energía
de enlace.
Los átomos se
combinan en proporciones fijas para generar moléculas concretas. Por ejemplo,
dos átomos de hidrógeno se
combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija
se conoce como estequiometría. Sin embargo, el mismo número y tipo de átomos puede
combinarse de diferente forma dando lugar a sustancias isómeras.
Orbitales: Para una
descripción y comprensión detalladas de las reacciones químicas y de las
propiedades físicas de las diferentes sustancias, es muy útil su descripción a
través de orbitales,
con ayuda de la química cuántica.
Un orbital atómico es una función matemática que describe la disposición de uno o dos
electrones en un átomo. Un orbital molecular es el análogo en las moléculas.
En la teoría del orbital
molecular la formación del enlace covalente se debe a una combinación matemática de
orbitales atómicos (funciones de onda) que forman orbitales moleculares, llamados así
porque pertenecen a toda la molécula y no a un átomo individual. Así como un
orbital atómico (sea híbrido o no) describe una región del espacio que rodea a
un átomo donde es probable que se encuentre un electrón, un orbital molecular
describe también una región del espacio en una molécula donde es más factible
que se hallen los electrones.
Al igual que un
orbital atómico, un orbital molecular tiene un tamaño, una forma y una energía
específicos. Por ejemplo, en la molécula de hidrógeno molecular se combinan dos
orbitales atómicos, ocupado cada uno por un electrón. Hay dos formas en que
puede presentarse la combinación de orbitales: aditiva y substractiva. La
combinación aditiva produce la formación de un orbital molecular que tiene
menor energía y que presenta una forma casi ovalada, mientras que la
combinación substractiva conduce a la formación de un orbital molecular con
mayor energía y que genera un nodo entre los núcleos.
Los orbitales son
funciones matemáticas para describir procesos físicos: un orbital únicamente
existe en el sentido matemático, como pueden existir una suma, una parábola o una raíz cuadrada. Los átomos y las moléculas son también
idealizaciones y simplificaciones: un átomo y una molécula solo existen en
el vacío, y en
sentido estricto una molécula solo se descompone en átomos si se rompen todos
sus enlaces.
En el "mundo
real" únicamente existen los materiales y las sustancias. Si se confunden los objetos reales con los modelos
teóricos que se usan para describirlos, es fácil caer en falacias lógicas.
- Disolución:
En agua, y en otros disolventes (como la acetona o el alcohol), es posible disolver sustancias, de forma que quedan disgregadas en
las moléculas o en los iones que las componen (las disoluciones son transparentes). Cuando se supera cierto límite, llamado solubilidad,
la sustancia ya no se disuelve, y queda, bien como precipitado en
el fondo del recipiente, bien como suspensión, flotando en pequeñas partículas (las suspensiones
son opacas o traslúcidas).
Se denomina concentración a la medida de la cantidad de soluto por
unidad de cantidad de disolvente.
Medida
de la concentración: La concentración de una disolución se
puede expresar de diferentes formas, en función de la unidad empleada para
determinar las cantidades de soluto y disolvente. Las más usuales son:
·
g/l (gramos por
litro) razón soluto/disolvente o soluto/disolución, dependiendo de la
convención
·
% p/p (concentración porcentual en peso) razón
soluto/disolución
·
% V/V (concentración porcentual en volumen) razón
soluto/disolución
·
M (molaridad) razón
soluto/disolución
·
N (normalidad) razón
soluto/disolución
·
m (molalidad) razón
soluto/disolvente
·
ppm (partes por
millón) razón soluto/disolución
- Acidez o
basicidad de sustancias: El pH es una escala logarítmica para
describir la acidez de
una disolución acuosa. Los ácidos, como por ejemplo el zumo de limón y
el vinagre, tienen
un pH bajo (inferior a 7). Las bases, como la sosa o
el bicarbonato de sodio, tienen un pH alto (superior a 7).
El pH se calcula
mediante la siguiente ecuación: donde es la
actividad de iones hidrógeno en la
solución, la que en soluciones diluidas es numéricamente igual a la molaridad
de iones hidrógeno que cede el
ácido a la solución.
·
una solución neutral (agua ultra pura) tiene un pH de 7, lo que implica una
concentración de iones hidrógeno de 10-7 M;
·
una solución ácida (por ejemplo, de ácido sulfúrico)tiene un pH <
7, es decir, la concentración de iones hidrógeno es mayor que 10-7 M;
·
una solución básica (por ejemplo, de hidróxido de potasio) tiene un pH > 7, o sea que la concentración de
iones hidrógeno es menor que 10-7 M.
Formular y la
nomenclatura de los elementos químicos y compuestos:
La IUPAC, un organismo internacional, mantiene unas reglas
para la formulación y nomenclatura química. Este organismo es la autoridad universalmente
reconocida en nomenclatura y terminología químicas. De esta forma,
es posible referirse a los compuestos químicos de forma sistemática y sin
equívocos.
Mediante el uso de fórmulas químicas es posible también expresar de forma sistemática las reacciones químicas, en forma de ecuación química.
Existen distintos tipos de fórmula química, útiles para brindar distinta información.





Comentarios